溃疡性结肠炎(UC)是一种炎症性肠病(IBD),但其病因和发病机制仍不清楚。最新研究认为它与肠道炎症、屏障功能障碍和生态失调密切相关。然而,目前临床可用于UC的预防和治疗方案很少,饮食干预是缓解UC症状的主要策略,其中,益生元、益生菌以及合生素(益生菌与益生元结合使用的生物制剂)在改变肠道微生物群、调节免疫反应和增强屏障能力等方面表现出较强的应用前景。
2024年10月28日,中国农业大学王军军教授团队在Nature Communications(IF=14.7)上在线发表了一篇题为“Galactooligosaccharides and Limosilactobacillus reuteri synergistically alleviate gut inflammation and barrier dysfunction by enriching Bacteroides acidifaciens for pentadecanoic acid biosynthesis”的研究文章,通过代谢组学、转录组学、宏基因组学、FMT等技术手段,揭示了由GOS(低聚半乳糖)和L. reuteri(罗伊氏乳杆菌)组成的合生素通过促进B. acidifaciens(产酸拟杆菌)合成C15:0(十五烷酸),从而缓解肠道炎症和屏障功能障碍,阐明了合生素在治疗UC和其他肠道炎症性疾病的潜力。(麦特绘谱提供Q300全定量检测服务)
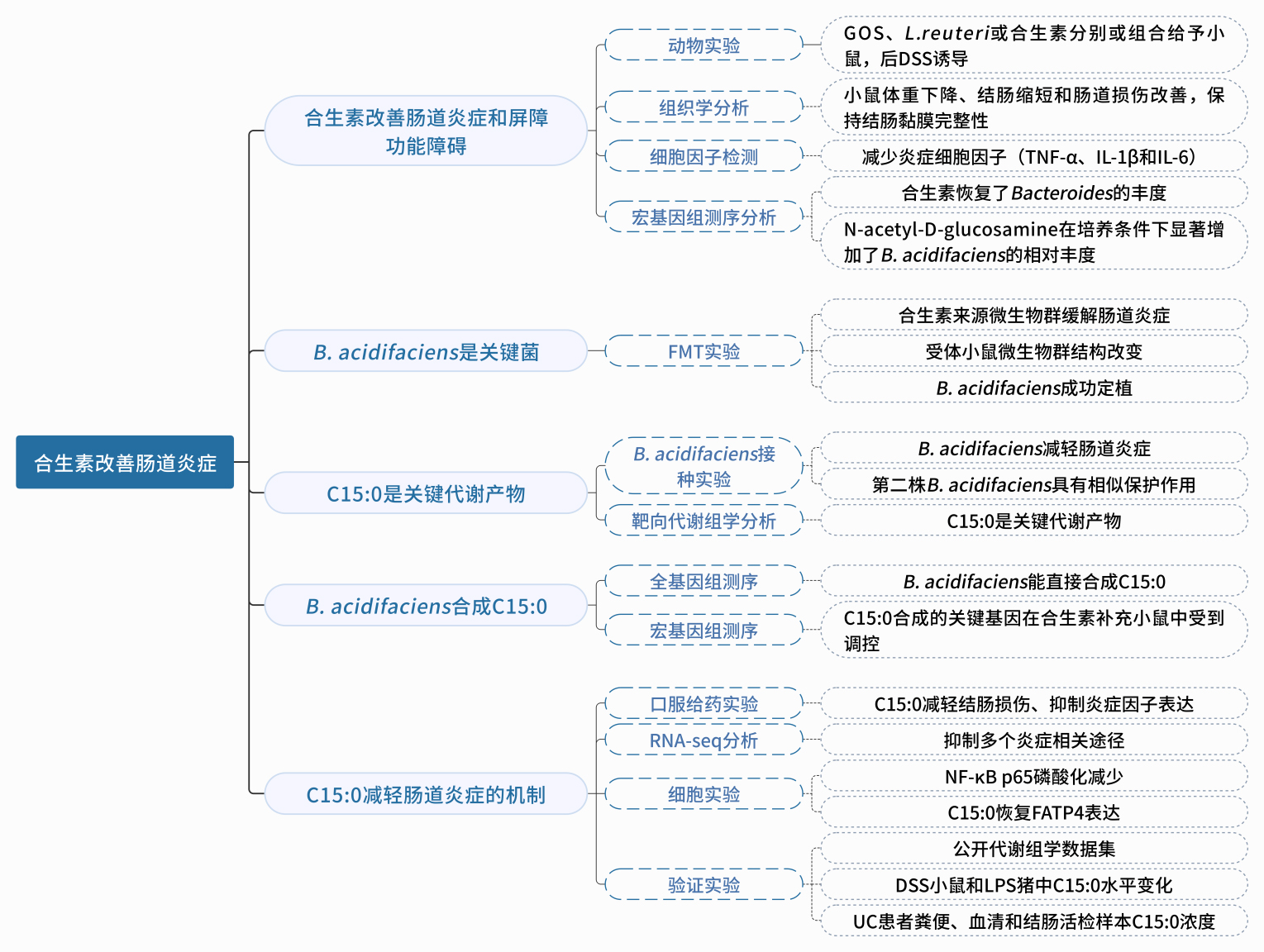
研究思路
图1. 技术路线
研究结果
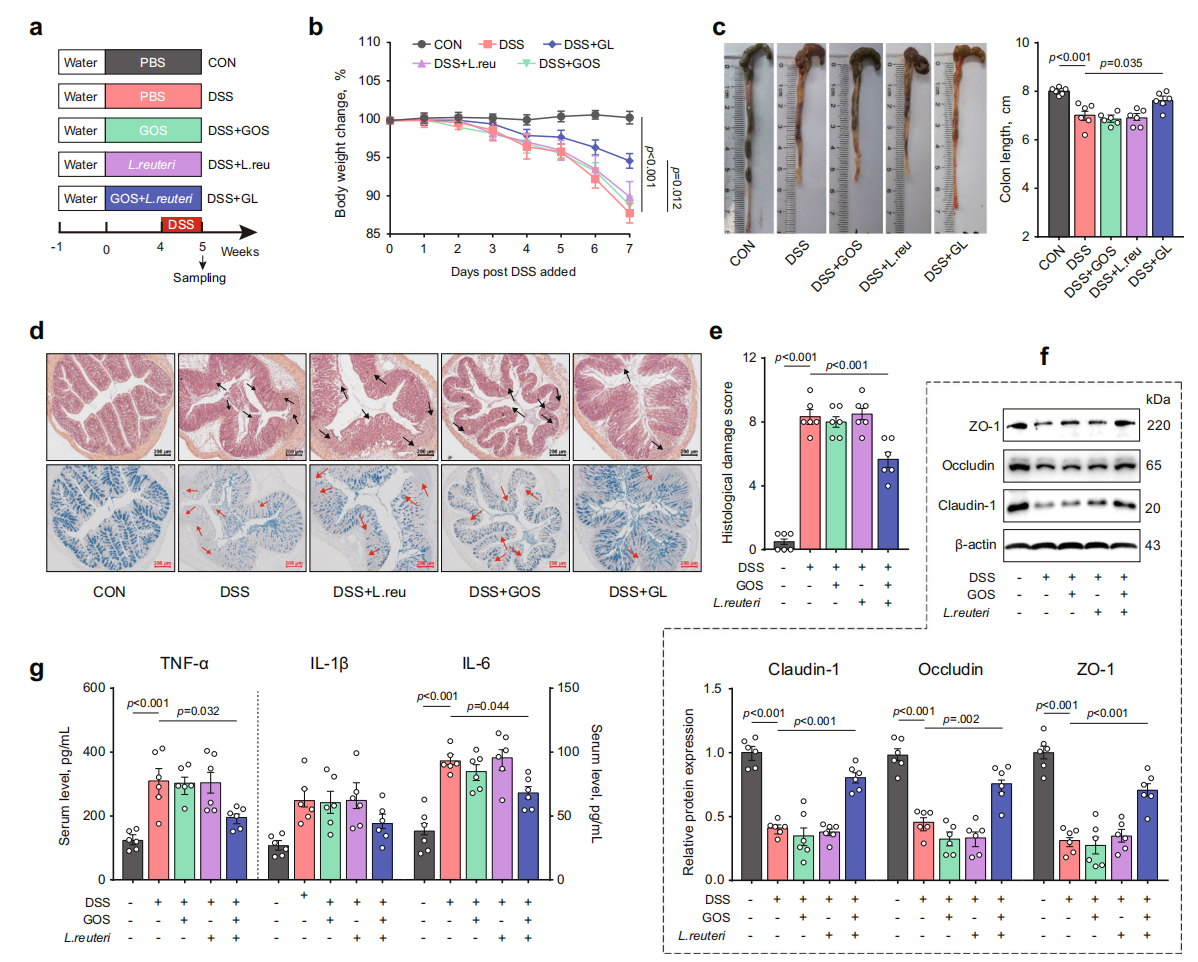
1. 合生素改善肠道炎症和屏障功能障碍,富集产酸拟杆菌
为了研究由GOS和L. reuteri组成的合生素对肠道炎症和屏障功能的影响,给小鼠单独或联合给药GOS和L. reuteri四周,DSS(葡聚糖硫酸钠)治疗一周,结果表明合生素对DSS诱导的小鼠肠道炎症和屏障功能具有显著的改善作用,这种改善作用包括逆转体重下降、结肠缩短和肠道损伤,保持结肠粘膜完整性,以及减轻肠道炎症。此外,合生素能够恢复DSS处理小鼠中Bacteroides(特别是B. acidifaciens)的丰度。
图2. 合生素改善肠道炎症和屏障功能障碍
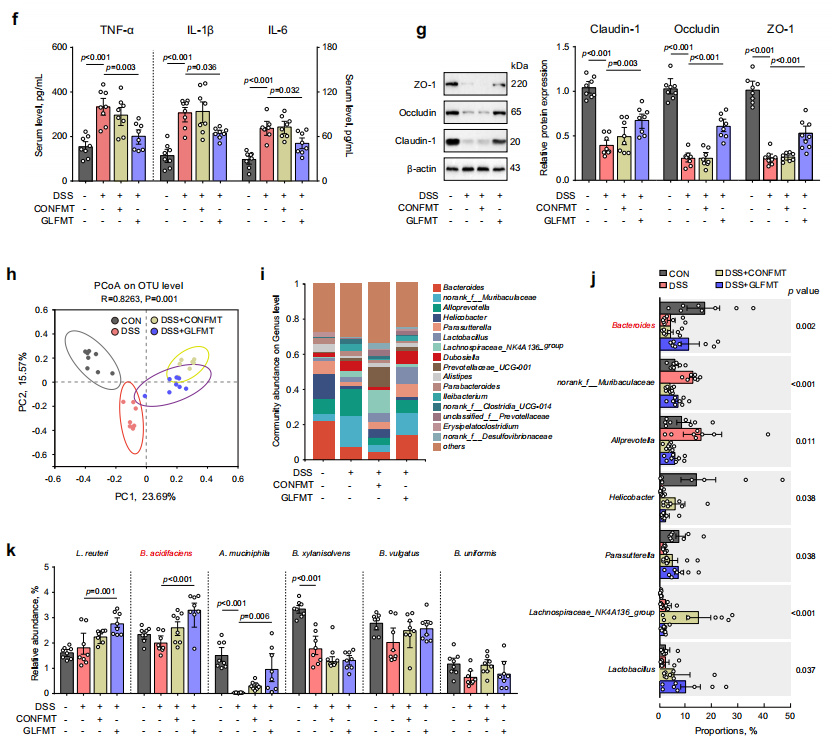
2. 合生素来源微生物群缓解肠道炎症和屏障功能障碍
通过粪菌移植(FMT)研究合生素来源的微生物群对缓解小鼠肠道炎症和屏障功能障碍的效果,与对照组微生物群相比,合生素来源的微生物群能够有效减轻DSS小鼠体重下降、结肠长度缩短以及肠道黏膜表面损伤,抑制血清中促炎细胞因子(TNF-α、IL-1β和IL-6)水平。此外,FMT还改变了受体小鼠的粪便微生物群结构,其中Bacteroides(拟杆菌属)和Lactobacillus(乳杆菌属)在接收合生素来源微生物群的小鼠中增加,且B. acidifaciens成功在肠道中定植。
图3. B. acidifaciens在合生素补充受体小鼠中富集
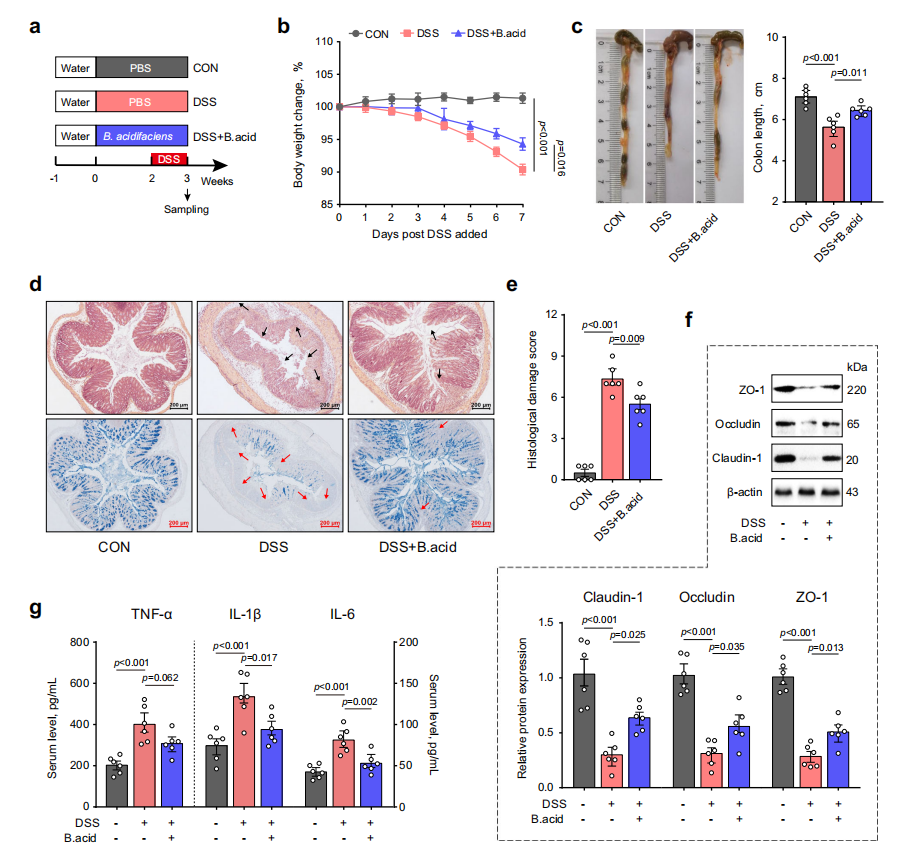
3. B. acidifaciens缓解肠道炎症和屏障功能障碍
进一步评估B. acidifaciens在肠道炎症和屏障功能障碍中的作用,对小鼠进行B. acidifaciens灌胃实验,结果显示,B. acidifaciens显著减轻了DSS诱导的肠道损伤。此外,B. acidifaciens还部分恢复了紧密连接蛋白的表达,并抑制了促炎细胞因子的表达。
图4. B. acidifaciens缓解肠道炎症和屏障功能障碍
4. C15:0减轻肠道炎症反应和屏障功能障碍
通过全定量Q300代谢组学技术对DSS小鼠的粪便样本进行靶点定量检测,其中十五烷酸(C15:0)下调最为显著,服用合生素后,粪便中C15:0含量升高。在FMT受体小鼠中也观察到C15:0浓度增加,表明C15:0可能是减轻肠道炎症和缓解屏障功能障碍的关键代谢产物。
图5. 合生素增加小鼠体内十五烷酸含量
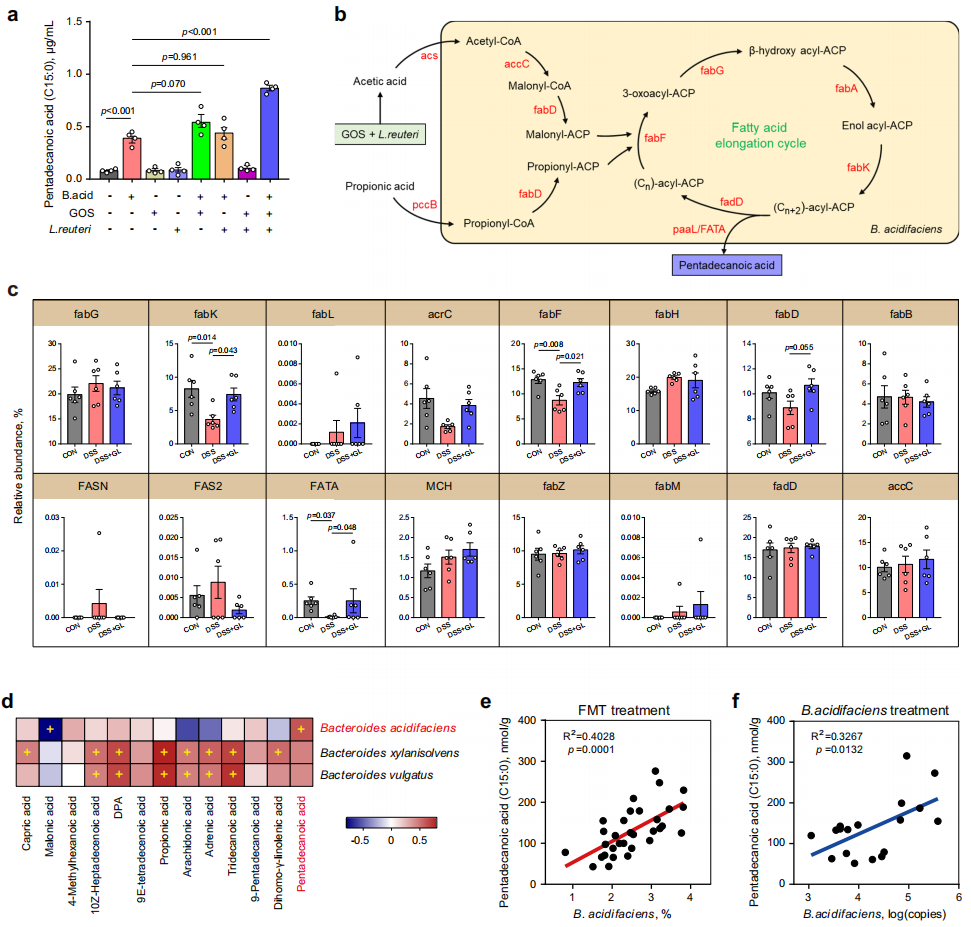
5. B. acidifaciens合成C15:0
为了确定B. acidifaciens是否能直接合成C15:0,将GOS、L. reuteri和B. acidifaciens进行共培养,发现C15:0含量明显增加,而单独使用任何一种都只有边际效应。进一步对B. acidifaciens进行全基因组测序,发现合成C15:0的所有关键基因都存在,表明B. acidifaciens能直接产生C15:0。接着研究C15:0主要合成基因是如何在合生素补充小鼠中被调节的,进行宏基因组测序分析,发现DSS处理下调了fabK、acrC、fabF和FATA基因,而补充合生素后这些基因表达得到恢复,进一步表明了合生素能够富集B. acidifaciens加速C15:0的生物合成。
图6. B. acidifaciens调控C15:0合成
6. C15:0介导的肠屏障完整性保护的潜在机制
在发现C15:0是关键的代谢产物之后,为进一步揭示C15:0介导的肠道屏障完整性保护的潜在机制,给DSS小鼠口服C15:0,并取结肠组织进行测序分析,发现C15:0抑制多条炎症相关通路,并抑制促炎细胞因子mRNA表达。同时,C15:0抑制了DSS处理小鼠和LPS刺激的MODE-K细胞中NF-κB的激活,表现为NF-κB p65磷酸化的减少。此外,在合生素、B. acidifaciens处理的DSS小鼠中也表现出NF-κB p65磷酸化的减少。
研究还发现DSS小鼠、LPS刺激Caco-2细胞和MODE-K细胞中FATP4(脂肪酸转运蛋白4)的表达受到抑制,但C15:0处理能够恢复其表达,FATP4抑制剂实验能够显著逆转C15:0在LPS处理的MODE-K细胞中恢复紧密连接蛋白表达和抑制促炎细胞因子的作用。上述结果表明C15:0的抗炎和屏障保护作用是通过FATP4介导和抑制NF-κB激活来实现的。
图7. C15:0抑制NF-κB激活
7. 临床意义
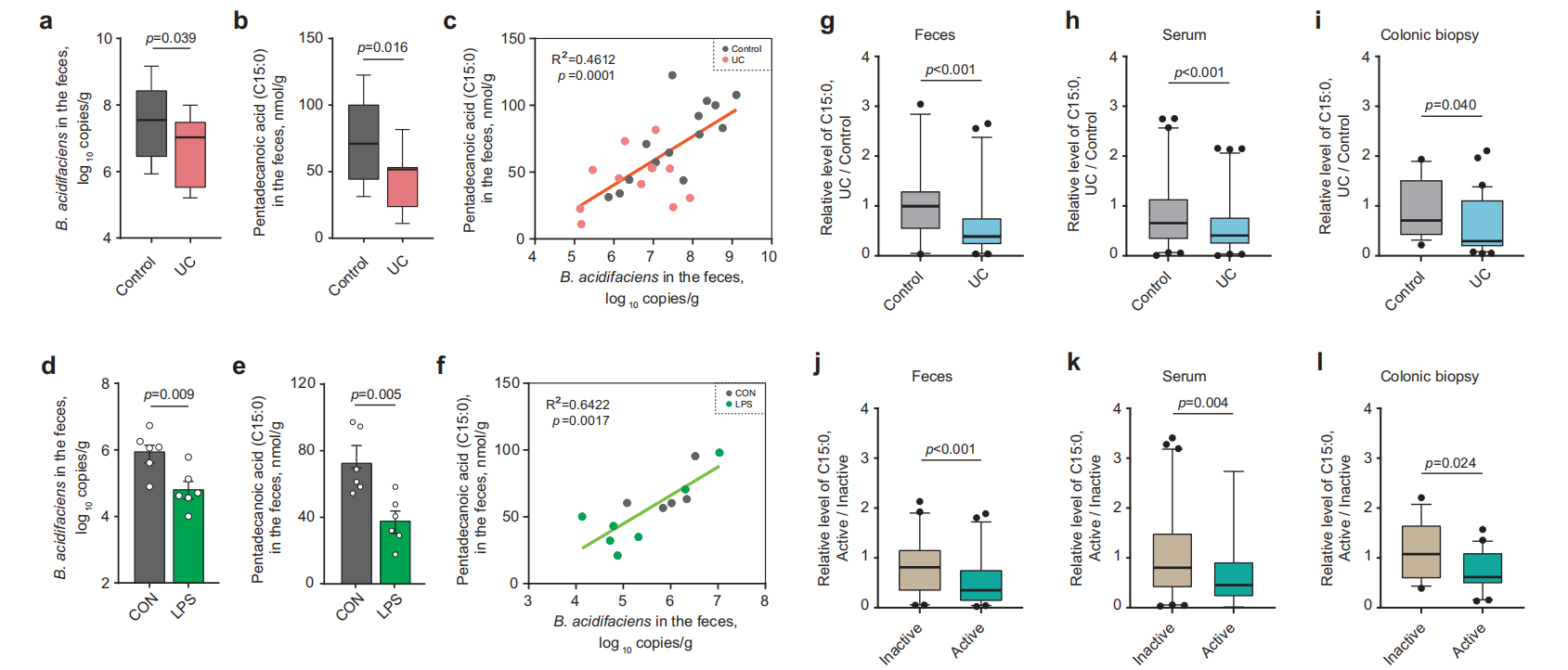
为了确认上述研究结果在其他肠道炎症性疾病中的临床意义,考察了LPS刺激的猪中B. acidifaciens和C15:0之间的关系;还分析了来自中国、美国、荷兰和挪威的多项近期研究,涉及503名健康对照者和649名溃疡性结肠炎(UC)患者的多个公开代谢组数据集的C15:0浓度,发现UC患者的粪便、血清和结肠活检样本中的C15:0浓度显著低于健康志愿者,且活动期UC患者的C15:0浓度也低于非活动期患者,表明了在不同物种和不同肠道炎症模型中,炎症和屏障功能障碍与B. acidifaciens和C15:0水平降低相关。
图8. UC患者和LPS诱导的猪中B. acidifaciens和C15:0呈现下调趋势
小结
本研究揭示了GOS和L. reuteri的组合促进了产酸拟杆菌合成十五烷酸来缓解肠道炎症和屏障功能障碍,为UC和其他肠道炎症性疾病提供了潜在的治疗途径。
参考文献
Galactooligosaccharides and Limosilactobacillus reuteri synergistically alleviate gut inflammation and barrier dysfunction by enriching Bacteroides acidifaciens for pentadecanoic acid biosynthesis. Nature Communications. 2024
请扫描二维码阅读原文
绘谱帮你测
本研究通过Q300全定量检测分析发现C15:0(十五烷酸)是调控溃疡性肠病的有效代谢产物,为后续探索抑制NF-κB活化与增强紧密连接蛋白表达来抑制肠道炎症的机制确立了精准的研究对象。麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。