
口服抗生素(Abx)是治疗细菌感染最常见、最有效的医学手段,但是在治疗过程中会严重破坏肠道菌群稳态,造成慢性疾病。此外,过度使用抗生素也会导致耐药细菌、耐药基因的积累,因此,通过减少抗生素对肠道菌群的副作用来优化抗生素的使用至关重要。
2022年7月,中国科学技术大学朱书教授与王育才教授团队在Nature Biomedical Engineering 上发表了题为“Glucosylated nanoparticles for the oral delivery of antibiotics to the proximal small intestine protect mice from gut dysbiosis”的文章。该文开发了一种新型口服抗生素递送载体-糖基化修饰的阳离子纳米颗粒(PGNPs),结合测序、胆汁酸靶向代谢组、分子实验等技术证实了口服PGNPs包裹的抗生素可显著降低对小鼠肠道微生物群的不利影响,降低抗生素相关菌群失调的疾病风险和抗生素耐药基因在菌群中的积累,该研究具有重要的临床转化潜力。中科新生命参与了该研究中胆汁酸靶向代谢组的相关工作。

研究材料
小鼠、四种纳米颗粒
技术路线
步骤1:钠依赖性葡萄糖转运体1和葡萄糖转运体2在小肠中高表达,但在结肠中不表达;
步骤2:葡萄糖基化纳米载体在近端小肠特异性吸收;
步骤3:PGNPs可减少肠道残留并增强血液循环;
步骤4:PGNPs-Abx能有效消除肺部肺炎链球菌感染;
步骤5:PGNPs递送可防止抗生素引起的生物失调;
步骤6:SGLT1抑制剂可以消除PGNPs-Abx的保护作用;
步骤7:PGNPs递送抗生素可改善与肥胖相关的生物失调;
步骤8:PGNPs递送抗生素可减少与失调相关的Citrobacter rodentium感染;
步骤9:PGNPs递送抗生素可降低肠道微生物群中的抗生素耐药基因。
研究结果
1. 钠依赖性葡萄糖转运体1 (SGLT1)和葡萄糖转运体2(GLUT2)在小肠中高表达,但在结肠中不表达
肠上皮细胞顶端的葡萄糖摄取是由葡萄糖转运体介导的,通过RNA测序发现SGLT1在小肠中的表达量比在结肠中的表达量高19倍,此外,GLUT2、GLUT5和GLUT7在小肠中的表达水平高于结肠,作者也验证了人样本SGLT1在小肠中高表达,但在结肠中不表达。因此,作者提出SGLT1和GLUT2在小肠中的高分布可能使葡萄糖转运体介导的纳米颗粒在近端小肠中的靶向作用成为可能。
2. 葡萄糖基化纳米载体在近端小肠特异性吸收
基于上述发现,作者设计了通过利用葡萄糖-葡萄糖转运体结合能力靶向近端小肠的纳米载体。共设计并制备了四种纳米颗粒:NPs(纳米颗粒)、GNPs(葡萄糖基化纳米颗粒)、PNPs(阳性纳米颗粒)和PGNPs,将荧光染料包裹在内以便于观察纳米颗粒在体内的分布。结果发现与其他类型纳米颗粒相比,PGNPs在小肠中的信号强度较高,在大肠中的信号强度较低。肠上皮细胞对PGNPs的摄取高于其他NPs。此外,PGNPs与SGLT1共定位于近端小肠上皮细胞,且荧光信号强度与SGLT1表达呈正相关。总之,纳米颗粒的糖基化功能化通过葡萄糖转运体SGLT1促进其在近端小肠的吸收(图1)。
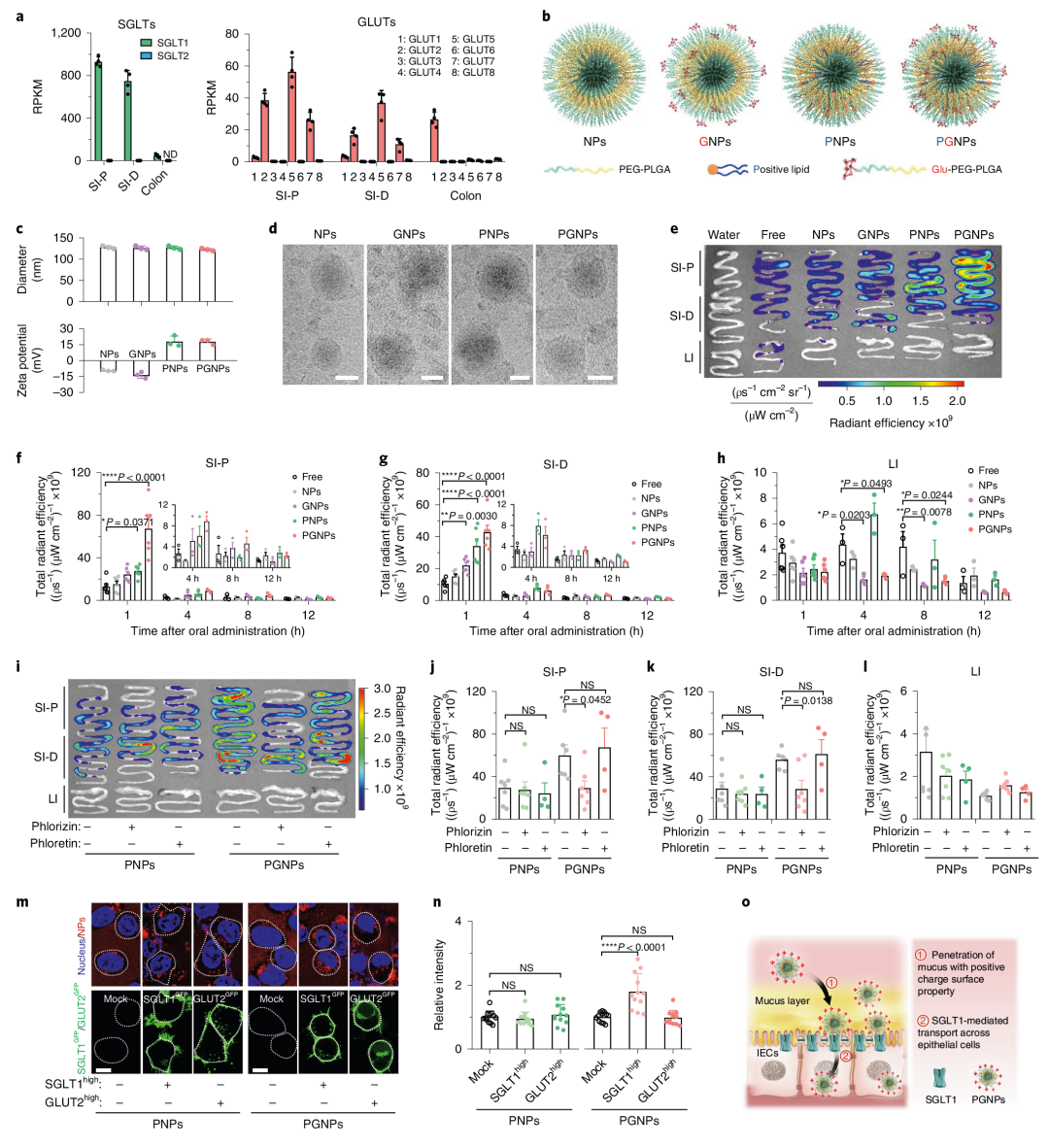
图1 糖基化纳米载体在近端小肠特异性吸收
3. PGNPs可减少肠道残留并增强血液循环
与其他纳米颗粒相比,PGNPs处理小鼠后其在粪便和盲肠内容物中残留更少,且血液中浓度更高。作者进一步研究了PGNPs作为载体是否可以增加抗生素的生物利用度和血液循环,使用模型抗生素氨苄西林(Amp)研究发现处理4小时后,PGNPs-Amp组的Amp血清浓度比游离Amp高20.9倍,且PGNPs-Amp组在前4小时内的生物利用度比其他组高2.4-4.8倍。游离Amp处理小鼠盲肠和粪便中Amp残留量分别达到46.4和303.5 μg g-1,而PGNPs -Amp处理小鼠盲肠和粪便中Amp残留量分别为0.05和0.69 μg g-1。表明纳米颗粒的糖基化功能减少了其粪便/盲肠内容物残留,并促进了在血液中的吸收(图2)。
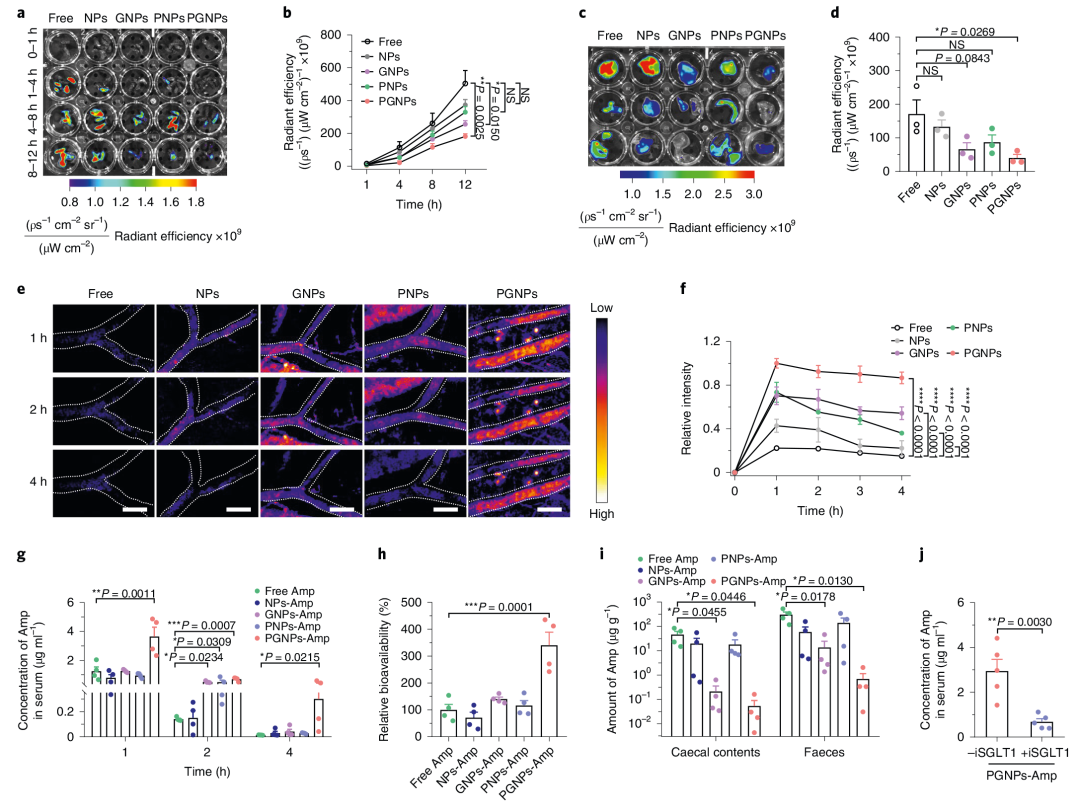
图2 PGNPs能减少肠道残留,促进血液循环
4. PGNPs-Abx能有效消除肺部肺炎链球菌感染
为了测试纳米载体传递系统是否会影响抗生素的抗菌功效,作者在肺炎链球菌介导的肺部感染小鼠模型中,评估了不同配方的Amp负载纳米颗粒与游离Amp的抗菌功效。结果发现与使用游离Amp和其他负载Amp的纳米颗粒处理的小鼠相比,PGNPs-Amp或GNPs-Amp组小鼠的炎症显著降低,组织损伤减弱。此外PGNPs-Amp对肺部细菌的清除效率明显更高,与5倍剂量的游离Amp抗菌功效相当。表明基于糖基化纳米载体途径的抗生素递送在治疗系统性感染方面优于游离抗生素(图3)。
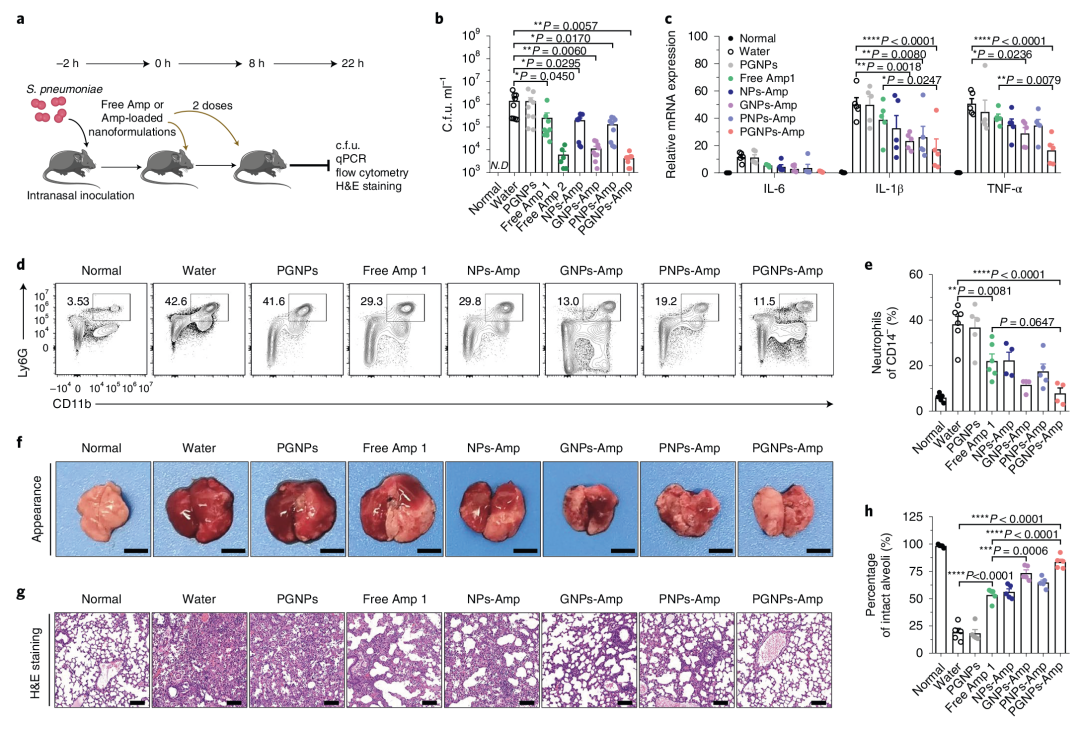
图3 PGNPs-Abx能有效消除肺部肺炎链球菌感染
5. PGNPs递送可防止抗生素引起的生物失调
作者在多个时间点测试了氨苄西林和万古霉素与相同剂量的各种抗生素负载纳米颗粒对肠道菌群的影响。结果发现游离Abx处理导致粪便α-多样性大幅减少,粪便微生物群落结构普遍破坏。与游离Abx或其他NPs-Abx处理相比,PGNPs-Abx和GNPs-Abx处理对肠道微生物群的干扰较低,且粪便微生物群丰富度和群落结构的恢复更快。此外PGNPs-Abx处理组近端和远端小肠内容物中观察到的物种数量和微生物群落组成几乎没有变化,而游离Abx处理组的微生物数量明显减少,干扰较大。结果表明糖基化纳米颗粒的递送在很大程度上可以防止抗生素引起的微生物群改变,包括细菌丰富度、多样性和组成的变化,且PGNPs递送还可以防止抗生素引起的小肠失调(图4)。
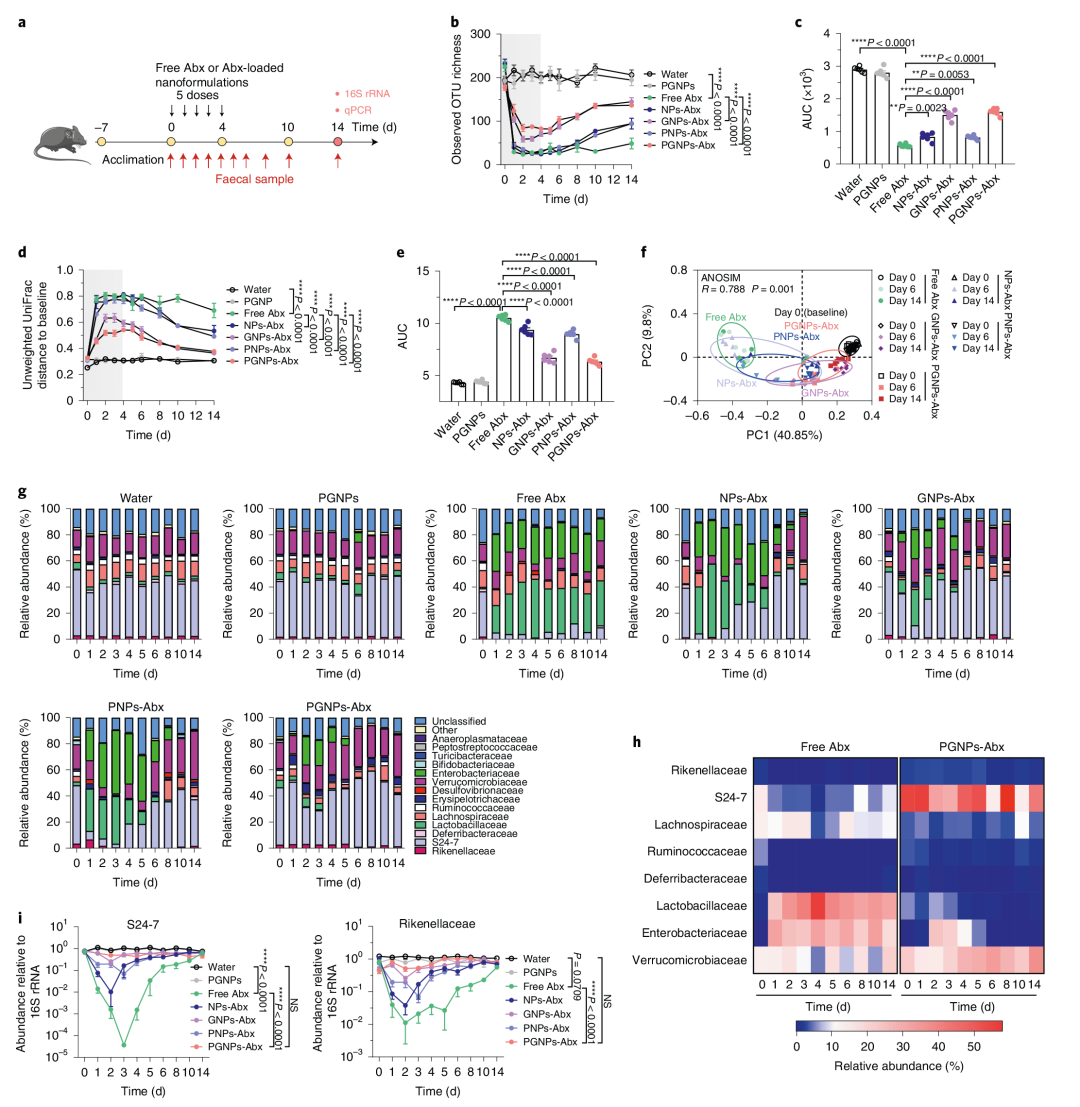
图4 PGNPs递送可防止抗生素诱导的生物失调
6. SGLT1抑制剂可以消除PGNPs-Abx的保护作用
为了验证PGNPs对抗生素诱导的生物失衡的保护作用是否依赖于SGLT1,作者使用SGLT1抑制剂根皮苷(iSGLT1)来研究PGNPs- Abx对肠道微生物群的影响。与未使用抑制剂的PGNPs-Abx组相比,与抑制剂联合施用的PGNPs-Abx组中的微生物多样性显著减少,微生物组成也有较大的干扰,且恢复缓慢。而在PNPs-Abx和与iSGLT1联合PNPs-Abx处理的小鼠则表现出较大的干扰和缓慢的恢复。表明由于SGLT1转运体在近端小肠中靶向吸收纳米颗粒,PGNPs递送可保护小鼠免受抗生素诱导的微生物群干扰(图5)。
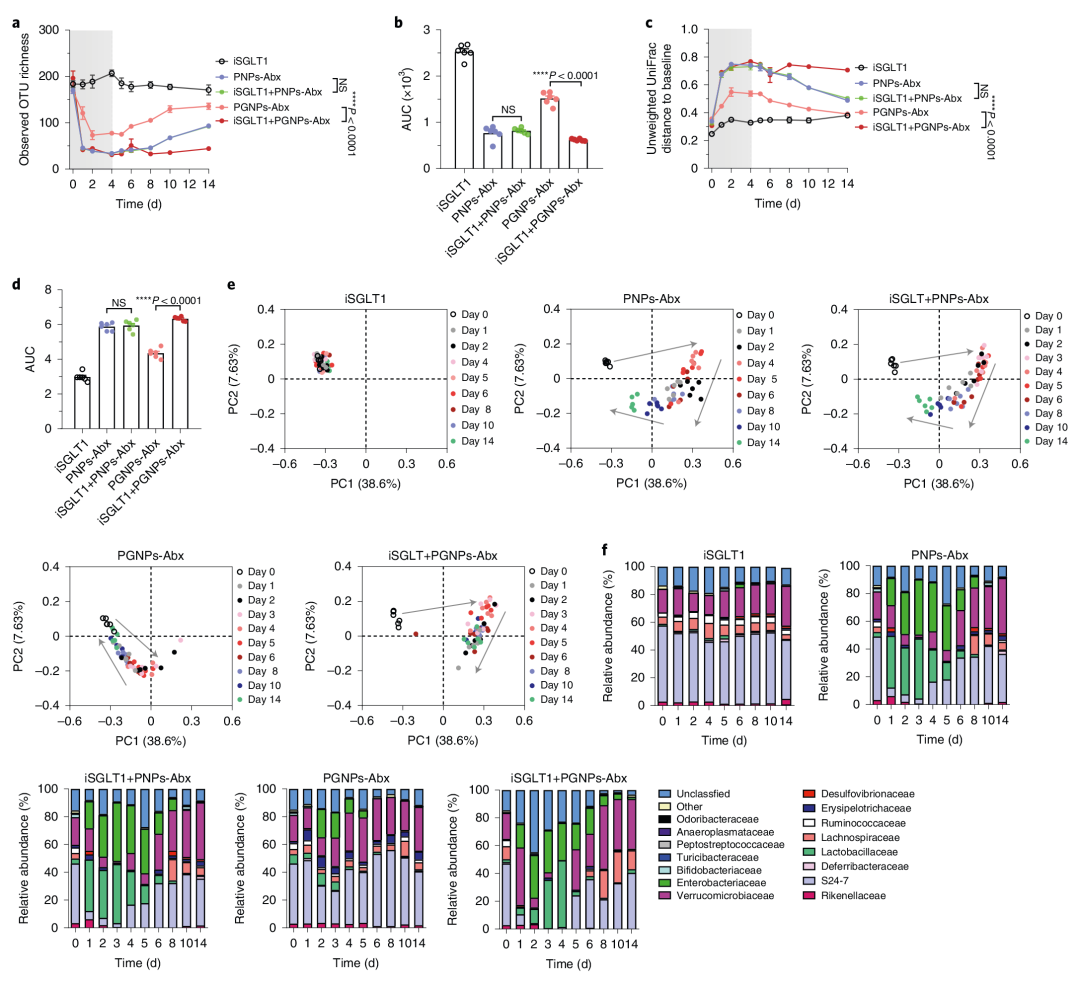
图5 SGLT1抑制剂可消除PGNPs-Abx的保护作用
7. PGNPs递送抗生素可改善与肥胖相关的生物失调
作者采用高脂饮食(HFD)诱导的肥胖小鼠模型研究负载抗生素的纳米颗粒对抗生素相关代谢综合征的潜在影响。与游离Abx组或其他NPs-Abx组相比,PGNPs-Abx组中HFD诱导的体重和脂肪质量的积累及肝脂肪变性较轻,且微生物群影响较低。作者进一步从机理上研究PGNPs是如何保护小鼠免受抗生素诱导的代谢综合征,发现游离Abx显著改变胆汁酸水平,而PGNPs递送抗生素则不会引起胆汁酸水平的系统性改变。接着通过粪便微生物群移植(FMT)实验发现与接受PGNPs-Abx处理小鼠肠道菌群的小鼠相比,接受游离Abx处理小鼠肠道菌群的小鼠体重增加更多,葡萄糖耐受性和肝脏总胆固醇更高,肝脏脂肪变性更严重。表明PGNPs递送抗生素可缓解与代谢异常相关的生态失调(图6,7)。
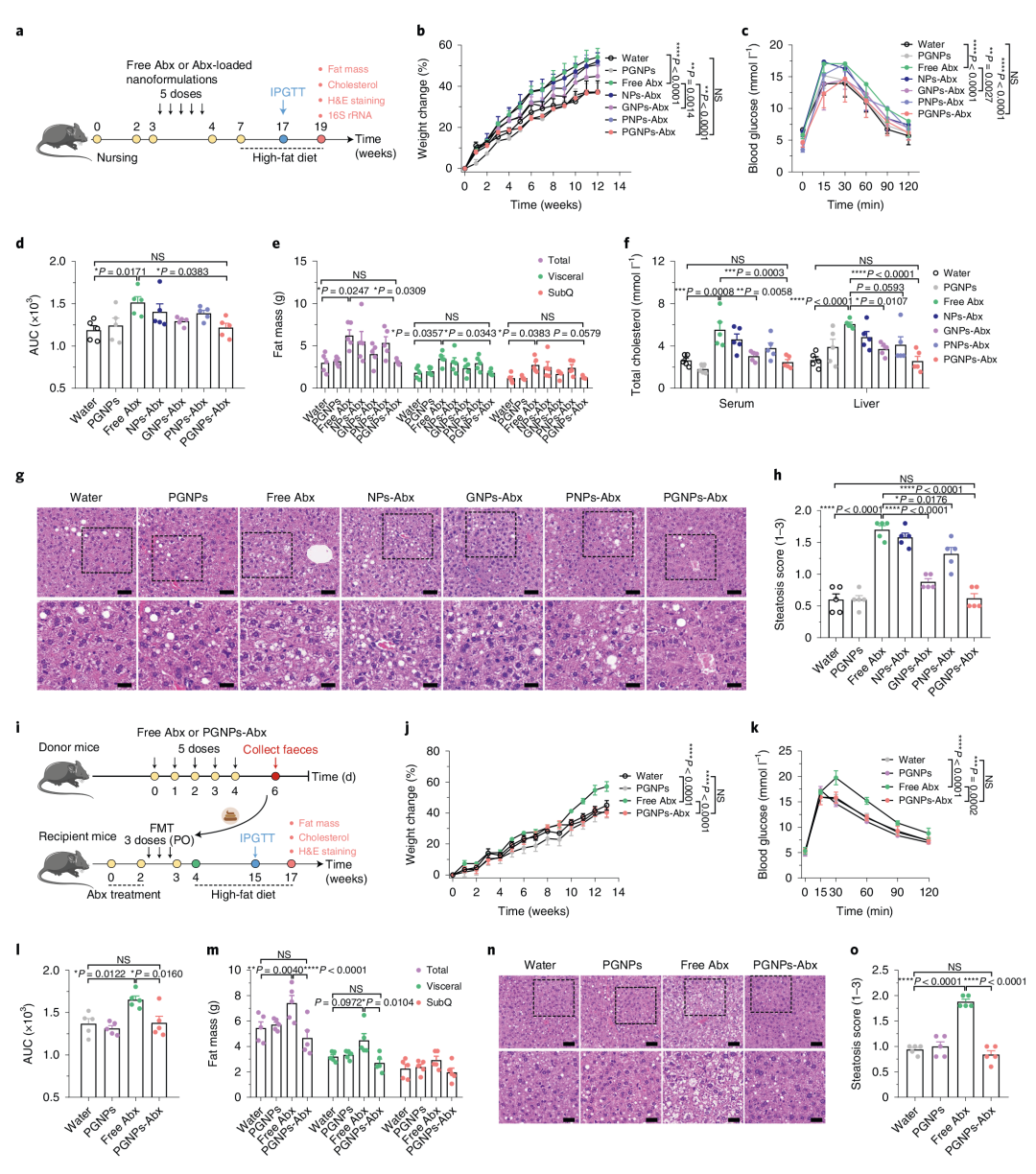
图6 PGNP介导的抗生素递送可改善与肥胖相关的生物失调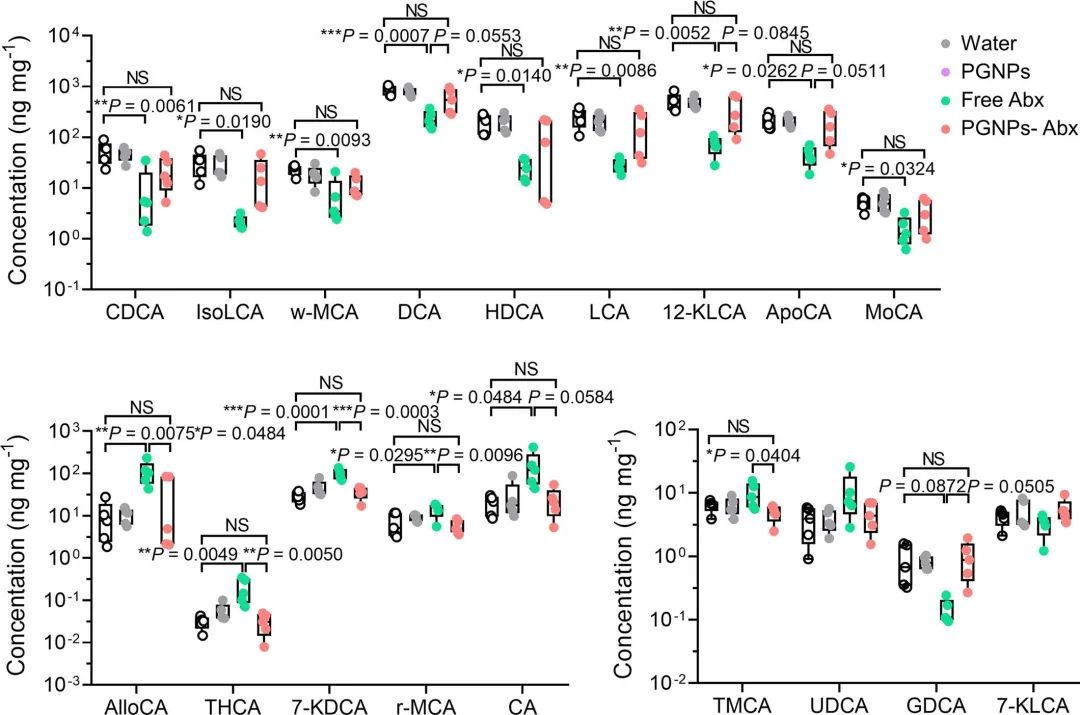
图7 粪便胆汁酸检测
8. PGNPs递送抗生素可减少与失调相关的Citrobacter rodentium感染
抗生素诱导的生物失调引起的另一个重要副作用是对致病性肠道感染的易感性增加。作者评估了使用游离Abx和不同负载Abx的纳米颗粒处理对C. rodentium肠道感染严重程度的潜在差异影响。结果发现与未使用抗生素处理的对照组小鼠相比,用抗生素处理5 d的小鼠对C. rodentium感染的敏感性增加,而经PGNPs-Abx预处理的小鼠则没有差异。接着作者进一步研究了SGLT1抑制剂对C. rodentium感染的影响,结果表明糖基化纳米载体递送抗生素可以降低对致病性感染的易感性,避免微生物群的失调(图8)。
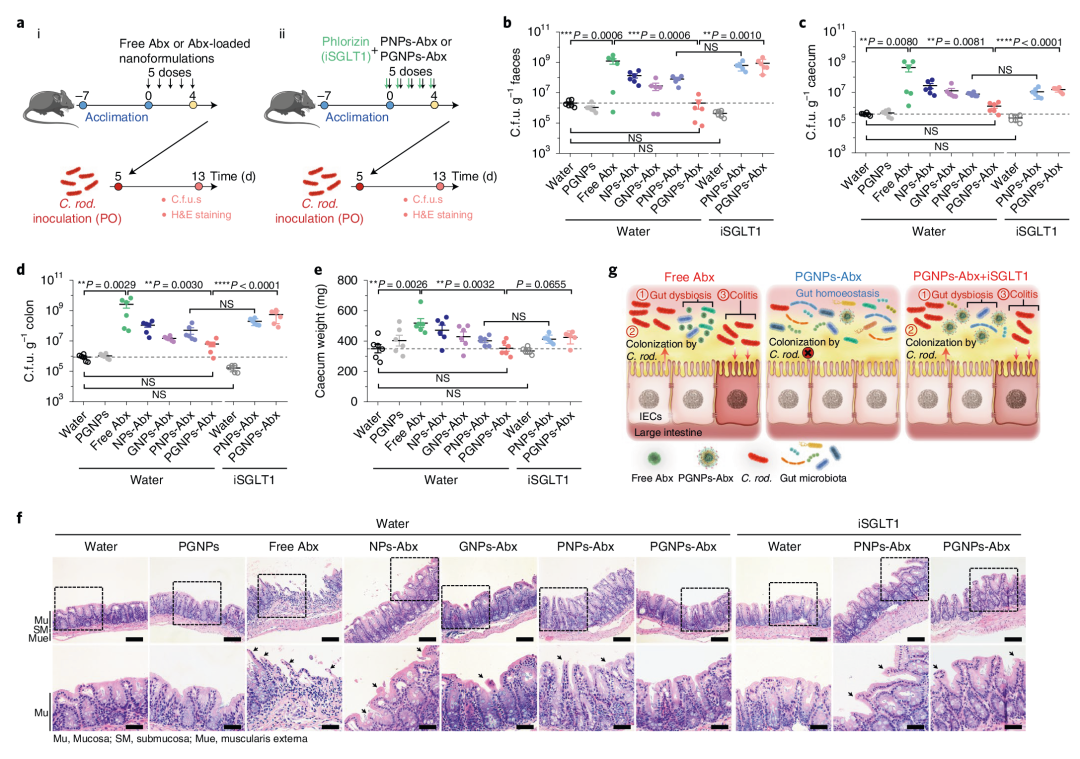
图8 PGNPs递送抗生素可减少与失调相关的Citrobacter rodentium感染
9. PGNPs递送抗生素可降低肠道微生物群中的抗生素耐药基因
作者对PGNPs-Amp/游离Amp处理的小鼠粪便样本进行宏基因组测序分析发现PGNPs的递送可全面防止抗生素诱导的抗生素耐药基因积累。此外与PGNPs-Amp处理组相比,游离Amp处理组粪便样本中促进氨苄青霉素耐药性基因的拷贝数显著增加,产生更多氨苄西林耐药菌落等,表明PGNPs递送策略减少了肠道菌群对抗生素的暴露,并减弱了已知抗生素耐药基因的诱导(图9)。
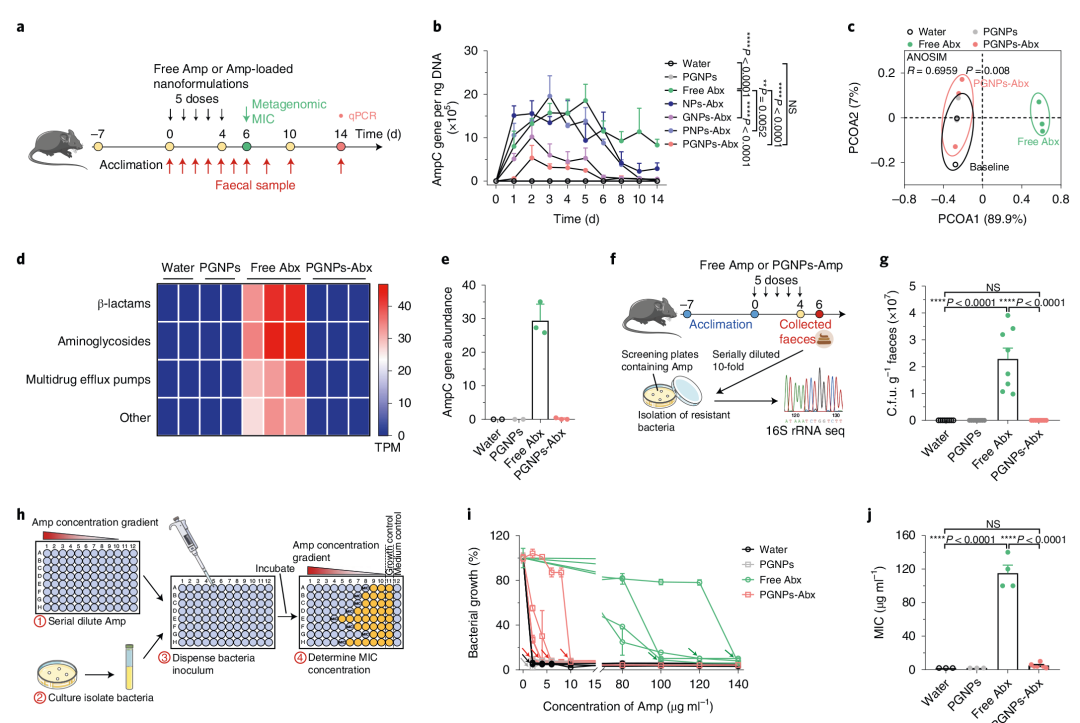
图9 PGNP介导的抗生素递送减少了肠道微生物群中的抗生素抗性基因
小编小结
作者利用葡萄糖转运体SGLT1在小肠特异性高表达的特点,设计了糖基化修饰的阳离子纳米载体,并证实了糖基化的纳米载体对氨苄西林、氯霉素和万古霉素的递送有效。PGNP系统减少了对微生物群的干扰,口服PGNPs-Abx可提高抗生素的生物利用度,并减少了由失调引起的不良反应。
