
云序优势:
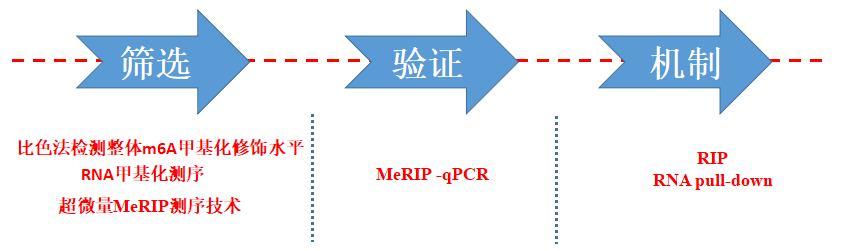
国内10分RNA甲基化文章平台
率先实现超微量技术,低至500ng
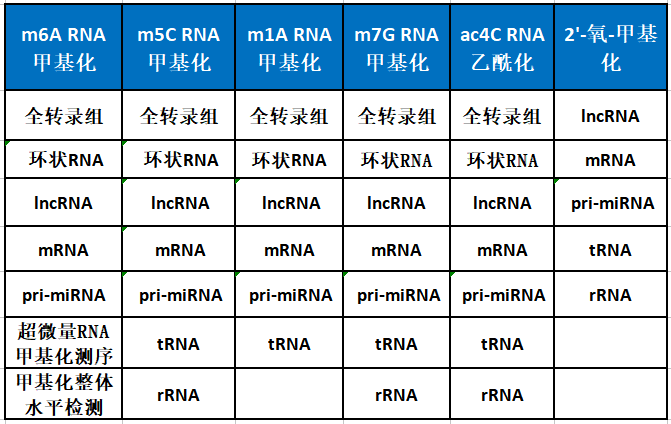
全分子覆盖(circRNA,lncRNA,mRNA等)
全物种覆盖(动物、植物全覆盖)
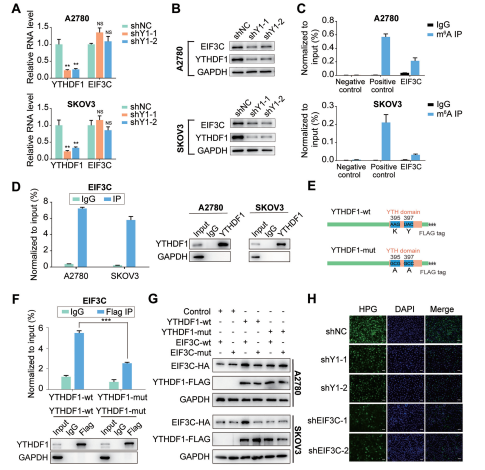
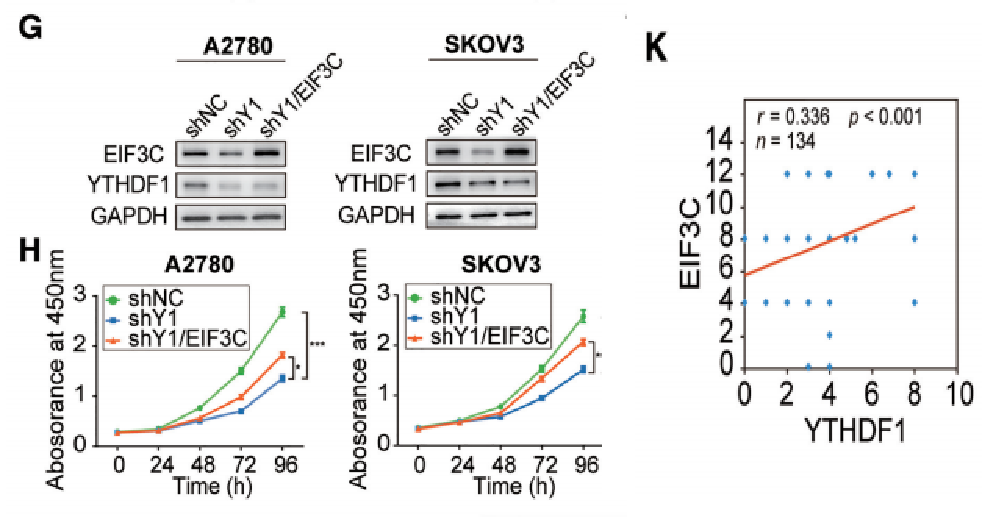
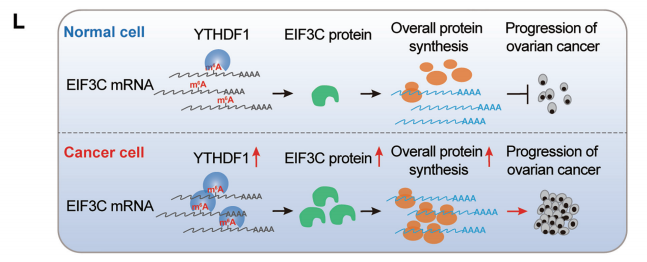
circRNA和m6A再次秀恩爱携手登上Nature Communication
“雨露均沾”---- RNA甲基化“搭讪”成熟miRNA又出新花样
上海云序生物科技有限公司
Shanghai Cloud-seq Biotech Co., Ltd
地址:上海市松江区莘砖公路518号20号楼3楼
作者:上海云序生物科技有限公司 2020-03-04T10:23 (访问量:4916)











云序优势:
国内10分RNA甲基化文章平台
率先实现超微量技术,低至500ng
全分子覆盖(circRNA,lncRNA,mRNA等)
全物种覆盖(动物、植物全覆盖)

上海云序生物科技有限公司
Shanghai Cloud-seq Biotech Co., Ltd
地址:上海市松江区莘砖公路518号20号楼3楼
地 址: 上海市松江区莘砖公路518号24号楼4楼
联系人: 戴小姐
电 话: 021-64878766
传 真: 021-64878766
Email:market@cloud-seq.com.cn;liuqingqing@cloud-seq.com.cn
杨宝峰院士团队RNA修饰又一成果 | 云序ac4C acRIP-seq助力揭示心脏I/R损伤的作用机制 (2024-12-03T00:00 浏览数:11379)
杨宝峰院士团队最新成果 | 云序助力揭示RNA修饰m7G调控心肌肥厚的机制研究 (2024-11-13T00:00 浏览数:12900)
Nature子刊| 重磅综述!一文总结「m6A修饰非编码RNAs」在各类肿瘤中的调控机制及作用 (暂无发布时间 浏览数:10766)
研究速览-eccDNA 2023年最新进展大放送! (暂无发布时间 浏览数:11469)
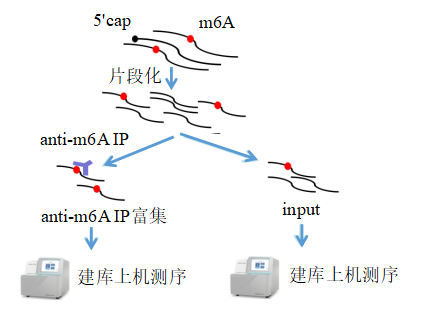
云序生物MeRIP-qPCR技术干货 (暂无发布时间 浏览数:11349)
技术干货| “eccDNA碱基序列的获取及引物设计”方法教程 (暂无发布时间 浏览数:10733)
云序客户m6A高分文章|揭示组蛋白乙酰化与m6A修饰在眼部黑色素瘤发生中的共同作用机制 (暂无发布时间 浏览数:6021)
Nat Biotechnol IF=47 | BID-seq:一种基于单碱基分辨率的假尿嘧啶(Ψ)修饰定量测序检测方法 (暂无发布时间 浏览数:5896)
北大伊成器团队Nature Reviews重磅发文:非m6A热门修饰调控与功能一文速览! (暂无发布时间 浏览数:9095)
用户文章m6A专题|IF=9.8|m6A去甲基化酶ALKBH5缺乏会加重钴致神经退行性损伤 (暂无发布时间 浏览数:5886)